为进一步贯彻实施《williamhill威廉希尔官网临床试验质量管理规范》,江苏省药品监督管理局将通过“江苏省williamhill威廉希尔官网行政审批系统”接收williamhill威廉希尔官网临床试验严重不良事件报告,现就有关事项通告如下:
依据《williamhill威廉希尔官网临床试验质量管理规范》第四十四条规定,“申办者应当在获知死亡或者危及生命的临床试验williamhill威廉希尔官网相关严重不良事件后7日内、获知非死亡或者非危及生命的试验williamhill威廉希尔官网相关严重不良事件和其他严重安全性风险信息后15日内,向参与临床试验的其他williamhill威廉希尔官网临床试验机构、伦理委员会以及主要研究者报告,向申办者所在地省、自治区、直辖市药品监督管理部门报告,向williamhill威廉希尔官网临床试验机构所在地省、自治区、直辖市药品监督管理部门和卫生健康管理部门报告,并采取风险控制措施”。申办者可通过江苏政务服务网登录“江苏省williamhill威廉希尔官网行政审批系统”,在“williamhill威廉希尔官网/体外诊断试剂临床试验严重不良事件报告”事项中填写信息,上传《williamhill威廉希尔官网/体外诊断试剂临床试验严重不良事件报告表》(附件)。即日起,省局不再接受纸质报告表和传真件。
使用过程中如遇系统操作或技术问题,可致电系统运维(手机号:18851867144,电话:座机拨打8008101866、手机拨打4008101866,拨通后按4)进行咨询。
附件:williamhill威廉希尔官网体外诊断试剂临床试验严重不良事件报告表
附件
williamhill威廉希尔官网/体外诊断试剂临床试验
严重不良事件报告表
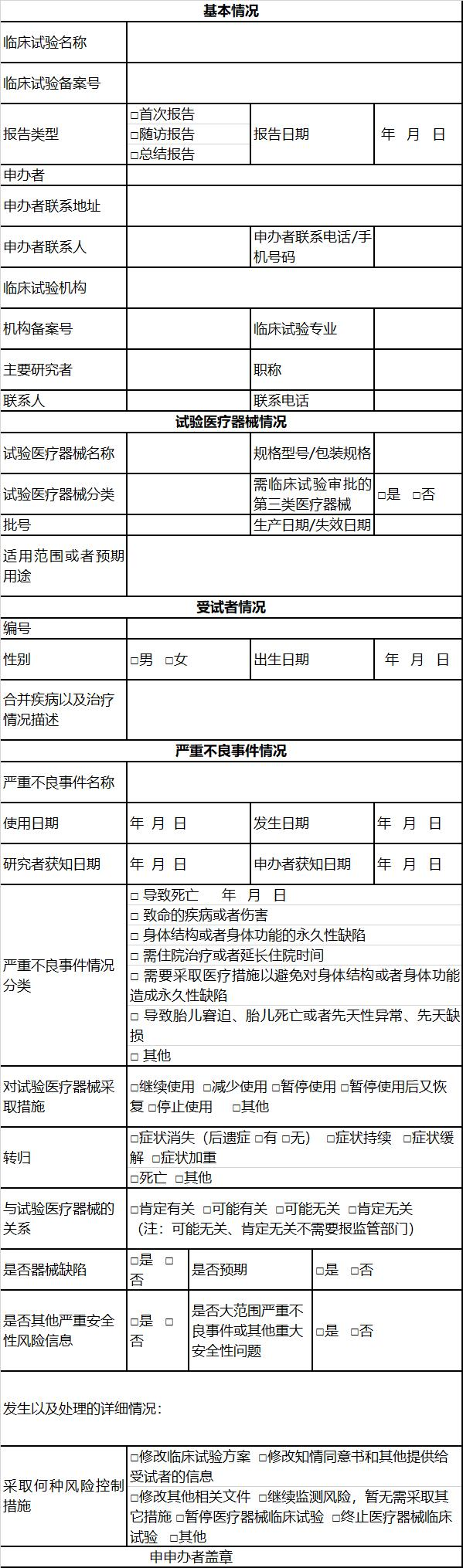
注:本表所述williamhill威廉希尔官网包括体外诊断试剂。